
A validação 3Q (IQ/OQ/PQ) é uma parte essencial da validação do projeto de dispositivos médicos, com o objetivo de verificar sistematicamente a conformidade e a confiabilidade de todo o processo, desde a produção até o desempenho. A seguir, analisamos os principais elementos da verificação 3Q para as características da laparoscopia de uso únicodispositivo de irrigação e sucção, evite citar dados que não possam garantir a precisão e otimize a lógica de apresentação.

I. IQ (Confirmação de Instalação)
Objetivo: Verificar se o equipamento de produção, o ambiente e o sistema de documentação atendem aos requisitos do projeto.
Fatores chave:
Instalação e calibração de equipamentos
O local de instalação, a configuração da fonte de energia e gás dos principais equipamentos (por exemplo, máquinas de moldagem por injeção, linhas de montagem) precisam estar em conformidade com os requisitos dos documentos técnicos.
Calibre sensores e instrumentos relacionados à produção (por exemplo, sensores de pressão, medidores de vazão, controladores de temperatura) para garantir que sua precisão atenda aos requisitos do processo.
Confirmação do ambiente de produção
Confirme se o controle de limpeza, temperatura e umidade do ambiente de produção atende ao processo do produto e aos requisitos regulamentares (por exemplo, para evitar contaminação e risco de contaminação cruzada).
Os registros de monitoramento ambiental precisam ser completos, incluindo, mas não se limitando a, controle de partículas, carga microbiana e outros parâmetros básicos.
Auditoria do Sistema de Documentação
Confirme se os SOPs do equipamento, registros de manutenção, desenhos de projeto e lista de materiais (BOM) estão completos e em versões controladas.
Revise os documentos de qualificação do fornecedor de matéria-prima (por exemplo, certificados de qualidade, relatórios de biocompatibilidade) para garantir a conformidade da cadeia de suprimentos.
II. OQ (Qualificação Operacional)
Objetivo: Verificar a capacidade do equipamento e do processo de operar de forma estável sob parâmetros definidos.
Fatores chave:
Teste de limite de parâmetro de processo
Verifique os limites superior e inferior dos parâmetros do processo de moldagem por injeção (por exemplo, temperatura, pressão, tempo) para garantir que o silicone esteja totalmente vulcanizado e livre de defeitos (por exemplo, bolhas de ar, sob vulcanização).
Teste a consistência do lote da produção de moldes de múltiplas cavidades para garantir que as dimensões críticas do produto (por exemplo, diâmetro da cavidade, tamanho da interface) atendam aos requisitos do projeto.
Validação de componentes funcionais
Teste de vedação: Verifique o desempenho de vedação do atrator de descarga através do teste de retenção de pressão para garantir que não haja vazamentos.
Validação da função da válvula: Teste a velocidade de resposta e a repetibilidade da comutação do modo de enxágue/sucção para confirmar sua confiabilidade.
Capacidade de controle de processo
Avalie a estabilidade do processo dos principais parâmetros do processo (por exemplo, analise a distribuição de dados por meio de métodos estatísticos) para garantir a robustez do processo.
Verifique a eficácia dos sistemas de inspeção on-line (por exemplo, inspeção visual, teste de pressão) para garantir a capacidade de detecção de defeitos.
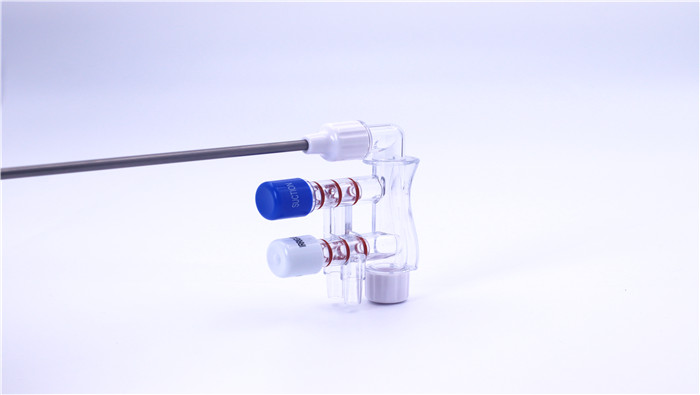
III. PQ (Qualificação de Desempenho)
Objetivo: Verificar se o desempenho do produto final atende às necessidades clínicas e aos requisitos regulatórios.
Fatores chave:
Avaliação de biocompatibilidade
Conclua os testes de biocompatibilidade necessários de acordo com os padrões internacionais (e.g. ISO série 10993), incluindo itens básicos como citotoxicidade e sensibilização.
Verifique a segurança química (por exemplo, dissolução, resíduos) dos componentes em contato com o paciente.
Esterilização e validação de embalagens
Validade da esterilização: Confirme o nível de garantia de esterilidade do processo de esterilização por meio de testes de desafio de bioindicadores.
Controle de resíduos: Certifique-se de que os resíduos de esterilização (por exemplo, óxido de etileno) atendam aos requisitos das normas internacionais relevantes.
Integridade da embalagem: Verifique a vedação e a barreira bacteriana da embalagem durante a data de validade por meio do teste de envelhecimento acelerado.
Testes de simulação de função clínica
Verificação do desempenho do fluido: simule cenários cirúrgicos reais para testar a estabilidade do fluxo de lavagem e da pressão negativa de sucção.
Teste de fadiga: simule vários cenários de uso (por exemplo, conexão e desconexão repetidas, comutação de modo) para verificar a durabilidade dos instrumentos.
Teste de condições extremas: Avalie a confiabilidade funcional dos instrumentos em ambientes não ideais (por exemplo, baixa temperatura, alta temperatura).
Sistema de gestão e rastreabilidade de riscos
Identifique os principais pontos de risco (por exemplo, falha de vedação, aderência da válvula) por meio de ferramentas de análise de risco (por exemplo, FMEA) e desenvolva medidas de controle.
Estabelecer um sistema completo de rastreabilidade de lotes de produção para garantir a rastreabilidade de toda a cadeia, desde as matérias-primas até os produtos acabados.

IV. A integração e saída da verificação 3Q
Gerenciamento de integridade de dados
Certifique-se de que todos os dados de teste sejam rastreáveis e revisáveis, de acordo com os princípios básicos de integridade de dados (por exemplo, ALCOA).
Relatórios e Revisão
Gerar relatórios de validação IQ/OQ/PQ, documentar o tratamento de desvios e ações corretivas e preventivas (CAPA) e aprovar pelo departamento de qualidade.
Melhoria contínua
Otimize os parâmetros do processo ou detalhes do projeto com base nos resultados da validação, atualize a documentação técnica e os documentos de gerenciamento de riscos.
Conclusão
A validação 3Q de dispositivos descartáveis de irrigação e sucção laparoscópica deve ser centrada na "conformidade do equipamento - robustez do processo - confiabilidade do produto", e o núcleo é provar a conformidade geral de seu projeto, produção e desempenho por meio de métodos científicos. As empresas devem se concentrar no rigor da lógica de validação e evitar depender de
+86 18361958211
marketing@cndonho.com
+86 18361958211
No.2 Zhiwei Road, Qiandeng Town, Kunshan City, Jiangsu Province, China




